برای دههها، درمان سرطان بر تومورها، ژنها و سلولهای ایمنی متمرکز بود. شواهد انقلابی اکنون نشان میدهد که ما قدرتمندترین عامل تعیینکننده موفقیت درمان را نادیده گرفتهایم: میکروبیوم روده.
آمارهای کلیدی:
۴۰٪ افزایش در نرخ پاسخ
۶۰٪ بیماران به ایمونوتراپی پاسخ نمیدهند
۱۰۰ تریلیون باکتری روده ایمنی را تنظیم میکنند
۴ برابر بهتر از بیومارکر PD-L1
عضو گمشده در درمان سرطان
تریلیونها باکتری که در روده انسان زندگی میکنند اکنون نه به عنوان ناظران غیرفعال، بلکه به عنوان تنظیمکنندگان فعال پاسخهای ایمنی شناخته میشوند که میتوانند تعیین کنند آیا ایمونوتراپی سرطان موفق میشود یا شکست میخورد.
این یک سوال برانگیزاننده را مطرح میکند: آیا ما یکی از قدرتمندترین "داروها" در سرطانشناسی را به سادگی به این دلیل که ثبت اختراع نشده است، کمتر استفاده میکنیم؟
راز ایمونوتراپی: چرا در ۶۰٪ بیماران شکست میخورد؟
بازدارندههای ایست بازرسی ایمنی (ICIs) مانند PD-1، PD-L1 و CTLA-4 انقلابی در سرطانشناسی ایجاد کردهاند. با این حال، با وجود وعدههای آنها:
فقط ۳۰–۴۰٪ از بیماران پاسخهای پایدار را تجربه میکنند
بسیاری از بیماران مقاومت اولیه ایجاد میکنند
دیگران علیرغم موفقیت اولیه عود میکنند
ژنتیک به تنهایی نمیتواند این تغییرپذیری را توضیح دهد. مطالعات اخیر نشان میدهند که ترکیب میکروبیوم ممکن است پاسخ ایمونوتراپی را دقیقتر از بیومارکرهای توموری در برخی سرطانها پیشبینی کند.
شواهد منتشر شده کلیدی:
Nature (2023): پیوند میکروبیوتای مدفوع از پاسخدهندگان، حساسیت به ICI را در ۳۰٪ بیماران ملانوم مقاوم بازیابی کرد.
Science (2022): مکملسازی آکرمانسیا موکینفیلا نرخ پاسخ ضد PD-1 را در مدلهای سرطان ریه ۴۰٪ بهبود بخشید.
NEJM (2021): استفاده از آنتیبیوتیک در ۳۰ روز اول شروع ICI، بقای کلی را در بیماران NSCLC به مدت ۱۴ ماه کاهش داد.
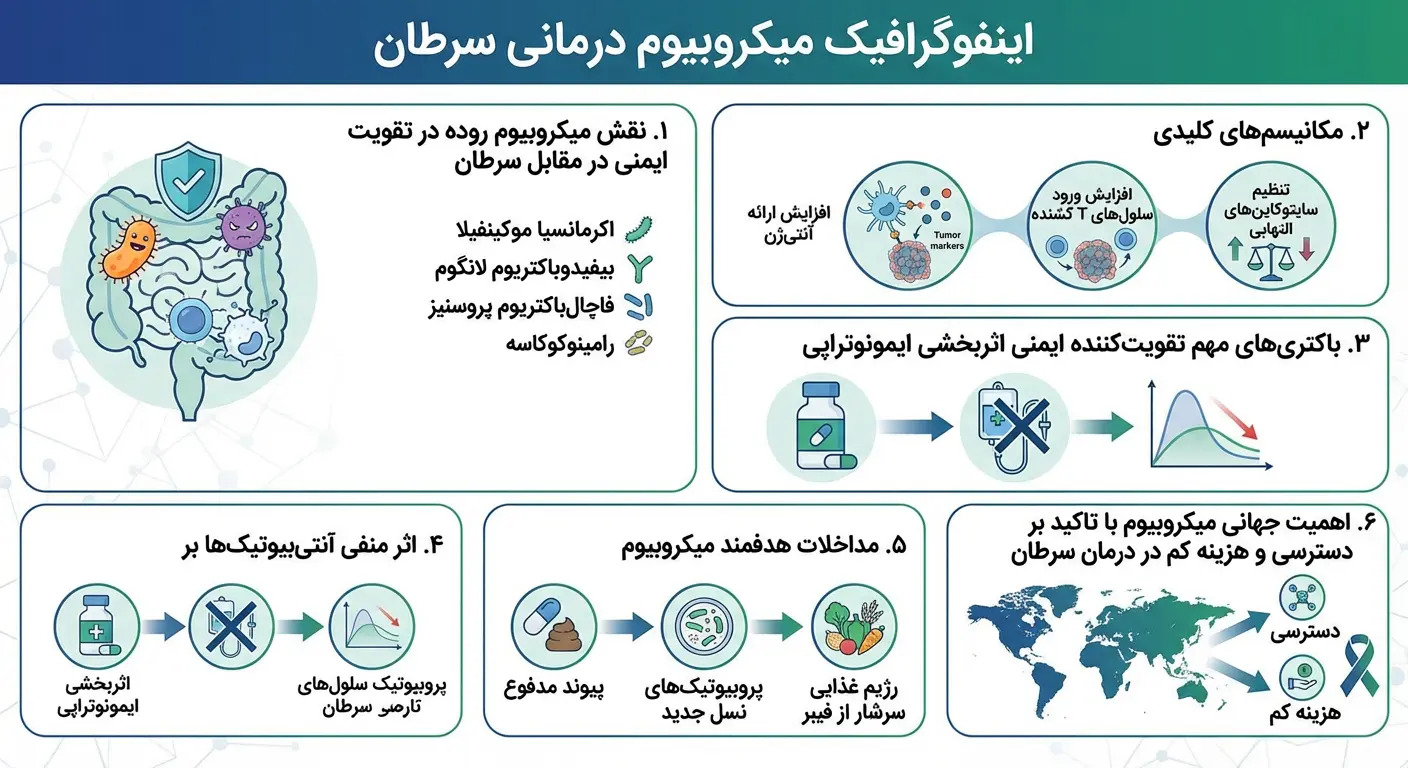
علم واضح است: باکتریهای روده ایمنی ضد سرطان را شکل میدهند
مکانیسمهای عمل:
ارائه بهتر آنتیژن: متابولیتهای باکتریایی سلولهای دندریتیک را آموزش میدهند تا آنتیژنهای توموری را بهتر به سلولهای T ارائه دهند.
افزایش نفوذ سلولهای T CD8+: باکتریهای خاصی نفوذ تومور توسط سلولهای T سیتوتوکسیک را افزایش میدهند و مستقیماً به سلولهای سرطانی حمله میکنند.
تنظیم سایتوکاین: میکروبیوم IL-12، IFN-γ و سایر سایتوکاینهای ضروری برای ایمنی ضد توموری را تنظیم میکند.
باکتریهای مفید قابل توجه:
بیماران پاسخدهنده به ایمونوتراپی اغلب غنای موارد زیر را نشان میدهند:
آکرمانسیا موکینفیلا
بیفیدوباکتریوم لانگوم
فاچالباکتریوم پروسنیز
گونههای رامینوکوکاسه
در مقابل، دیسبیوزیس — که اغلب ناشی از آنتیبیوتیکها، رژیم غذایی ضعیف یا شیمیدرمانی است — با نتایج بقای ضعیفتر همبستگی دارد.
آنتیبیوتیکها: خرابکار ناخواسته ایمونوتراپی
آنتیبیوتیکهای طیف وسیع که قبل یا در طول ایمونوتراپی تجویز میشوند، میتوانند با مختل کردن میکروبیوم، اثربخشی درمان را به طور قابل توجهی کاهش دهند.
دادههای بالینی:
| معیار نتیجه | با آنتیبیوتیک | بدون آنتیبیوتیک |
|---|---|---|
| نرخ پاسخ کلی | ۲۰٪ | ۴۵٪ |
| میانگین بقای بدون پیشرفت | ۳.۲ ماه | ۱۲.۸ ماه |
| بقای کلی ۲ ساله | ۲۵٪ | ۵۵٪ |
میکروبیوم به عنوان بیومارکر: آیا پیشبینیکنندهتر از PD-L1 است؟
بیان PD-L1، بار جهشی تومور (TMB) و وضعیت MSI به طور گسترده استفاده میشود — اما کامل نیست. شواهد نوظهور نشان میدهد:
تنوع میکروبیوم به شدت با پاسخ ایمونوتراپی همبستگی دارد
پروفایلسازی مبتنی بر مدفوع ممکن است از بیوپسیهای تک توموری بهتر عمل کند
میکروبیوم آمادگی ایمنی سیستمیک را منعکس میکند، نه فقط زیستشناسی تومور
این درها را به روی بیومارکرهای غیرتهاجمی، قابل تکرار و پویا باز میکند.
تمام ادعاهای این مقاله توسط انتشارات معتبر بررسی شده توسط همتا در: Nature، Science، New England Journal of Medicine، Cell، Journal of Clinical Oncology پشتیبانی میشود. تنظیم میکروبیوم باید تحت نظارت پزشکی به عنوان بخشی از مراقبت جامع سرطان انجام شود.
منابع:
Routy و همکاران، Science 2018; Gopalakrishnan و همکاران، Science 2018; Matson و همکاران، Science 2018; Derosa و همکاران، Nature 2023.